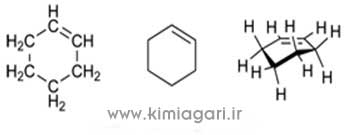
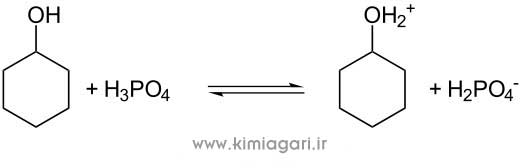
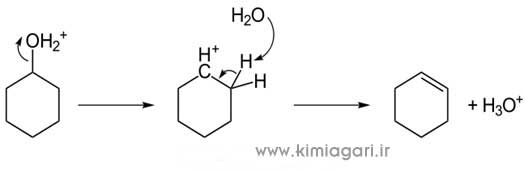
نام آزمایش: تعیین میزان آهن آرد به روش اسپکتروفتومتری
هدف آزمایش: دامنه کاربرد: این روش برای اندازه گیری آهن درغلات و آردهای حاصل از آنها – آردهای غنی شده و آماده شده برای پخت و فرآوردههای آنها کاربرد دارد.
وسائل و مواد آزمایش: خاکستر آرد- اسید کلریدریک – بن ماری – آزیتاتور- کاغذ صافی- بالن ژوژه- محلول استاندارد آهن – محلول هیروکسیل آمین – محلول تامپون استات
محلول ارتوفنانترولین
تئوری آزمایش: عنوان: اسپکتروفتومتری
هدف: آشنایی با دستگاه اسپکتروفتومتر
تئوری: اسپکتروفتومتر ناحیه مریی Spectrophotometer
تعریف اسپکتروفتومتری: اسپکتروفتومتری یک روش تجزیه دستگاهی است که در آن تابش الکترومغناطیسی در ناحیه مرئی و ماورا بنفش جذب ماده میشود، و از روی شدت جذب مقدار ماده تعیین میشود.
روشهای طیف سنجی براساس بر هم کنش تابش الکترومغناطیسی با ماده بنیان گذاری شده است و چون امواج الکترومغناطیس، حاصل کاهش سرعت ذرات با بار الکتریکی است بنابراین توسط ماده جذب شده و سبب افزایش سرعت ذرات میگردد. علاوه بر این انرژی نورانی در بر هم کنش با ماده و جذب آن توسط ماده، باعث برانگیختن ماده به ترازهای انرژی بالاتر میگردد. بنابراین بسته به شدت و قدرت انرژی وارده به ذره با ماده بر هم کنش کرده و پدیده خاصی را سبب میگردد که اساس اندازه گیریهایی نظیر اسپکتروفتومتری را تشکیل میدهد. و میتواند شامل کلیه نواحی طیف الکترومغناطیس از اشعه گاما و ناحیه مریی تا امواج رادیویی باشد. در این رابطه، روشهای جذب، نشر، شکست، پراش (Diffraction) و پلاریزه شدن نور را میتوان مورد توجه قرار داد که مهمترین آنها روشهای اسپکتروفتومتری جذبی و نشری و فلورسانس است.
طول موج نور مریی بیشتر و در نتیجه انرژی آن کمتر از UV است. در اثر تابش نور به ماده در آن نقل و انتقالات الکترونی صورت میگیرد، eها تحریک شده و به سطوح انرژی بالاتر میروند. بسته به ساختمان شیمیایی جسم، نقل و انتقالات الکترونی مختلفی میتواند صورت گیرد، و محل جذب بستگی به ساختمان شیمیایی ماده دارد. بنابراین از gmax برای شناسایی مواد استفاده میشود که طول موجی است که در آن حداکثر جذب صورت میگیرد و برای تعیین غلظت جسم مجهول gmax را به نمونه میتابانیم. مقدار جذب از قوانین جذب Bear & Lambert پیروی میکند و از رابطه A=e lc محاسبه میشود.
معمولا در محدودهای که جذب با غلظت رابطه خطی دارد، تعیین مقدار انجام میشود. اگر غلظت نمونه و استاندارد به هم نزدیک باشد و غلظتها هم در محدوده خطی باشند، میتوان با استفاده از تناسب محاسبات را انجام داد.
اجزاء و قسمتهای مختلف دستگاه اسپکتروسکوپاسپکتروفتومتر از دو بخش اسپکترومتر و فتومتر تشکیل شده است. اسپکترومتر بخشی است که نور منوکروم را ایجاد کرده و دارای منبع نور، عدسی، شکافها، منوکروماتور (صافی، منشور یا ((Grating system) میباشد. بخش فتومتر دارای اسباب سنجش نور میباشد.
۱- منبع نورانی: منبع نور مورد استفاده در اسپکتروفتومتر بسته به ناحیه مورد استفاده، متفاوت میباشد. برای نورهای مرئی از لامپ تنگستن استفاده میشود که نورهایی با طول موج بین ۳۵۰ تا ۸۰۰ نانومتر ایجاد میکند. و برای نورهای ماوراء بنفش (UV) از لامپ جیوه، هیدروژن استفاده میشود. این لامپها در ناحیه بین ۲۰۰ تا ۶۰۰ نانومتر بکار میروند. در دستگاههای پیشرفتهتر هر دو نوع لامپ وجود دارد.
۲- عدسیها: (آینهها): برای کنترل کردن مسیر نور، وجود عدسی لازم است. به جای عدسیها از آینههایی که به شکل نیمدایره یا محدب ساخته شدهاند میتوان استفاده نمود.
۳- شکافها (slits): در هر اسپکتروفتومتری دو شکاف وجود دارد: یکی را شکاف ورودی و دیگری را خروجی میگویند. شکافها رل مهمی در جداکردن نور دلخواه با طول موج مشخص دارند. به همین جهت اندازه این شکافها بسیار مهم هستند. بیشتر دستگاهها پیچی دارند که اندازه این شکافها را میتوان برحسب احتیاج تغییر داد. هر چه طول این شکافها بیشتر باشد پهنای نور عبوری (band-pass) بیشتر بوده و دامنه طول موج آن نیز زیاد میباشد و به عبارت دیگر نورهای دیگری که مورد نیاز نیستند عبور میکنند. این نور اضافی را Stray light مینامند
۴- منوکروماتور (monochromators): اشعه نورانی پس از عبور از عدسیها و شکاف مقدار و مسیر آنها کنترل شده سپس به دستگاهی که میتواند نور پلی کروم را به منوکروم تبدیل کند وارد میشود. پس نوری با طول موج مشخص و انتخابی به وجود میآورند. دو نوع منوکروماتور وجود دارد منشور و Grating.
۵- محل نمونه: ظرف محتوی نمونه را سل یا کووت (cuvett) مینامند که از جنس شیشه، کوارتز یا پلاستیک است. برای اندازه گیری شدت رنگ محلولها و بلانک بکار میرود. سلهای شیشهای و پلاستیکی برای ناحیه مرئی به کار میرود و در ناحیه ماوراء بنفش از سل کوارتز استفاده میشود. طول سلها معمولا ۱ سانتی متر است و سلهایی با طول cm ۱/۰ تا cm ۱۰ نیز موجود میباشد. محل قرار گرفتن نمونه بسته به اینکه دستگاه جایگاه جدا برای رفرنس (بلانک) دارد یا نه، Single beam و Double beam نام دارد. و کووتها برحسب نوع شیشه و شکل چند نوع میباشند.
۱- کووتهای مکعبی: سطح مقطع این کووتها مربع بوده و از جنس شیشه خالص (برای نورهای مرئی) و کوارتز (برای نور ماوراء بنفش) میباشند. شیشه نور مرئی را از خود عبور میدهد ولی نور ماوراء بنفش را به مقدار زیادی جذب میکند. کووتهای مکعب، گران و کارکردن و تمیز نگهداشتن آنها دقت بسیار لازم دارد.
۲- کووتهای گرد: سطح مقطع این دسته از کووتها گرد بوده و برای کارهای روزمره آزمایشگاهی بکار میروند. با همه دقتی که در ساختن کووتها میشود، مکرر دیده میشود که آیا A دو کووت مشابه، یکسان نیست. برای جلوگیری از استفاده کووتهای ناجور باید آنها را کالیبره نمود.
برای کالیبره کردن کووتها محلولی را که نسبتا پایدار است مثل هموگلوبین با غلظت ۵۰ میلی گرم درصد میلی لیتر تهیه مینمایند. باید T این محلول در طول موج nm ۵۴۰ برابر ۳/۰ ± ۵۰% باشد. راه دیگراینست که به جای کالیبره کردن کووتها از یک کووت برای شاهد و استانداردو نمونه استفاده کنند.
۶- دتکتور (نور سنج): نور پس از عبور از عدسیها و شکافها و منوکروماتور به محلول لوله آزمایش رسیده و از آنجا به نورسنج میرود. اسباب منوکروماتور، نور دلخواه و با طول موج مشخص را به لوله آزمایش میتاباند. رنگ این نور مکمل رنگ محلول است. اگر رنگ محلول سبز- آبی (مثل تعیین مقدار گلوکز بوسیله ارتو تولوییدین) به طول موج nm ۴۹۵-۴۷۵ باشد رنگ فیلتر- منشور یا گریتینگ باید نارنجی یا نزدیک آن با طول موج بین nm ۶۲۰-۶۰۰ باشد. چون رنگهای نارنجی مکملش سبز-آبی است. بنابراین وقتی منوکروماتور رنگ مکمل رنگ محلول را به لوله آزمایش میتاباند مقداری از آن به وسیله محلولی که در لوله وجود داشته و بستگی به غلظت مواد مورد آزمایش دارد، جذب شده و بقیه آن به نورسنج میرسد. نورسنج با تبدیل انرژی نورانی به انرژی الکتریکی قادر است که مقدار جذب این نور را به وسیله محلول و یا درصد ترانس – میتانس آن اندازه گیری نماید. دتکتورها شامل انواع فتوشیمیائی، فتوالکتریکی و حرارتی میباشد که در ناحیه مرئی و ماوراء بنفش از دتکتورهای فتوالکتریکی مانند فتوولتتیک و فتوتیوب و فتومولتی پلایر تیوب استفاده میشود.
۷- رکوردر (الکتریک سنج) در اسپکتروفتومتر احتیاج به دستگاهی است که جریان الکتریکی دتکتور را اندازه بگیرد. دو سیستم گالوانومتر و نول پوینت وجود دارد که در اسپکتروفتومترهایی که دارای نواحی مرئی باشند معمولا از یک گالوانومتر یا صفحه دیجیتالی استفاده میشود. دیاگرام زیر، طرح یک اسپکتروفتومتر ساده را نشان میدهد.
گالوانومتر دتکتور نمونه عدسی شکاف منوکروماتور شکاف عدسی منبع نور
طرز کار: ۱- پس از اتصال به برق مدتی باید صبر کرد تا دستگاه گرم شود
۲- طول موج ماکزیمم را روی دستگاه تنظیم مینمایند.
۳- در شرایطی که جا سلی دستگاه، خالی است با در باز یا بسته (بستگی به نوع دستگاه دارد) صفر ترانس میتانس را تنظیم میکنیم.
۴- بلانک آبی و بلانکهای دیگر را در جا لولهای دستگاه گذاشته آن را روی صددرصد T و یا صفر A تنظیم میکنند.
۵- نمونهها را در سل ریخته و مقدار جذب آنها را میخوانیم.
۶- سلها حتما باید تمیز بوده و قطرات محلول اطراف آن باید با دستمال کاغذی پاک شود.
مواد لازم: FeSCN محلول / آب مقطر
وسایل لازم: بالن ژوژه / دستگاه اسپکتروفتومتر/ دستمال کاغذی
روش آزمایش: ابتدا محلولهای ۳ و ۶ و ۵/۷ و ۹ و ۱۰ ppm تیوسیانات را آماده میکنیم و سپس دستگاه را روشن کرده و طول موج را بر روی ۴۸۰ تنظیم میکنیم و توسط محلول شاهد درصد جذب را بر روی صفر تنظیم میکنیم. سپس سل را بیرون آورده و درصد جذب را بر روی ۱۰۰% تنظیم میکنیم. حال دستگاه کالیبره شده است. یکی یکی محلولها را درون سل میریزیم و درون دستگاه قرار میدهیم و در دستگاه را میبندیم و در صد جذب را میخوانیم و در آخر محلول مجهول را هم درون دستگاه قرار میدهیم و با رسم نمودار غلظت مجهول مورد نظرمان را بدست میآوریم.
موارد خطا: نکات زیر را باید درباره کووتها رعایت کرد:
۱- هرگز قسمت پایین کووت را با دست نمیگیرند چون نور از این قسمت کووت عبور میکند.
۲- کووت را دو بار با محلول مورد آزمایش آبکشی مینمایند.
۳- موقع استفاده از کووتها آنها را با پارچه نرمی که پرز ندهد پاک میکنند در صورت امکان از کاغذهای مخصوص پاک کردن عدسی استفاده مینمایند.
۴- محلول داخل کووت باید عاری از حباب هوا باشد.
۵- کووت را طوری در اسپکتروفتومتر قرار میدهند که علامت مخصوص روی کووت به طرف خواننده باشد.
۶- معمولا از همان مسیری که کووت را در اسپکتروفتومتر قرار دادهاند از همان مسیر هم آن را خارج میکنند.
۷- وقتی از دستگاه استفاده نمیشود دریچه روی محفظه کووت را میبندند.
۸- کووتها را با محلول تمیز کننده قوی نمیشویند. حتی در محلولهای ضعیف نیز به مدت طولانی قرار نمیدهند.
۹- در صورت اجبار داخل کووت را با سوآپ پنبهای تمیز میکنند.
۱۰- از کووتهای کالیبره نشده استفاده نمیکنند.
۱۱- باید اندازه کووت و حجم محلول اندازه گیری مناسب باشد..
دستگاه اسپکتروفتومتری UV-VISاین دستگاه برای آنالیز غلظت عناصر موجود در محلولها مانند مس، وانادیوم و... مورد استفاده قرار میگیرد. مبنای اندازهگیری عناصر عبور پرتو نور از محلول و جذب آن توسط محلول و اندازهگیری شدت پرتو پس از جذب میباشد، که مطابق قانون بیر-لامبر متناسب با غلظت است. برای آنالیز عناصر ابتدا محلولهای مورد نظر رقیق شده و به هر محلول وابسته به عنصر مورد نظر معرف خاصی اضافه میشود. اضافه شدن این معرفها باعث تشکیل کمپلکسهای رنگی در محلول میشود که شدت رنگ ایجاد شده با غلظت عنصر در محلول متناسب است. این دستگاه دارای یک لامپ تنگستن یا سدیم است که پرتو تولیدی توسط این لامپها به نمونۀ موجود در ظرف مخصوص نمونهگیر تابیده میشود که با اندازهگیری شدت پرتو عبوری از ظرف میزان جذب و در نتیجه غلظت عنصر مورد نظر معلوم میشود.
امروزه استفاده از اسپکتروفتومتر در اندازه گیری پارامترهای مختلف بدلیل قیمت مناسب، سهولت کاربری، دقت و صحت زیاد بویژه در آنالیز موادغذایی و آب و فاضلاب جایگاه ویژهای یافته است. اما مزایای فوق خصوصا صحت نتایج در گرو استفاده از اسپکتروفتومتری پیشرفته و دقیق خواهد بود که در ذیل به برخی از نیازمندیهای ضروری در اسپکتروفتومتر اشاره میگردد.
سیمای نوری دستگاه اسپکتروفتومتربر اساس تئوریهای جدید نباید بخش متحرک زیادی در قسمت نوری فتومترها موجود باشد چرا که ممکن است تجهیزات فوق بدلیل حرکت مداوم فرسوده شده و بدلیل حساسیت زیاد و امکان ایجاد خطاء دستگاه مرتباً از حالت کالیبراسیون خارج شود که در این حالت خطاء تجزیه با این سیستمها افزایش مییابد. در اسپکتروفتومترهای فارو ۱۰۰ و۳۰۰ مرک آلمان این اصل کاملا رعایت شده است.
۲-شناسایی خودکارسل اندازه گیریطول سل اندازه گیری نیز از متغیرهای دیگری است که با تغییر اندازه آن فرمول محاسبه غلظت باید نسبت به این تغییر تصحیح گردد در غیر اینصورت نتیجه با خطایی فاحش همراه خواهد بود. برا ی رفع این مشکل نیز فتومترهای سری فارو مجهز به سیستم شناسایی خودکار اندازه سل بوده و با تغییر نوع سل محاسبات بصورت خودکارتصحیح میگردد.
۳-کدورت نمونهیکی از دلایل خطاء در سیستمهای فتومتری کدورت نمونه است البته کدورتی که با چشم چندان قابل تشخیص نیست اما د راندازه گیری مقادیر کم نمونهها در حد PPm و PPb باعث خطاءمیشود چرا که کدورت نمونه سبب جذب بخشی از نور عبوری از نمونه میگردد که در محاسبات به جای جذب نمونه لحاظ میگردد. تکنولوژی پیشرفته اسپکتروفتومترهای مرک آلمان اجازه میدهد جذب نمونه در سه طول موج مختلف اندازه گیری شود و از آنجا ئیکه جذب ناشی از کدورت مستقل از طول موج است بنابراین دستگاه بصورت خودکار جذب ناشی از کدورت را محاسبه و آنرا در محاسبات اندازه گیری غلظت تصحیح مینماید.
۴-تنظیمات خودکار اسپکتروفتومتریکی دیگر از منشاءهای خطا در اندازه گیری با اسپکتروفتومتر تنظیماتی است که کاربر برا ی انتخاب نوع آزمون یا آماده کردن دستگاه برا ی اندازه گیری پارامتری خاص انجام میدهد. در صورتی که کاربر خسته باشد امکان خطاء از این ناحیه افزایش مییابد. برای رفع این معضل فتومترهای سری فارو مجهز به اسکنر بارکد میباشد.
تمام کیتهای تولیدی مرک برای سیستمهای فتومتری در خود بارکدی به همراه دارند که چنانچه قبل از اندازه گیری در دستگاه قرار داده شود دستگاه خودکاربرا ی آن اندازه گیری تنظیم شده و دیگر به هیچ تنظیم دستی نیاز نیست. درعین حال این ویژگی اجازه میدهد کاربرهایی که تخصصی درآنالیزبا فتومترندارند بتوانند براحتی از این سیستم استفاده نمایند.
۵-عدم نیاز به محلول شاهدیکی از ویژگیهای منحصر بفرد فتومترهای سری فارو مرک آلمان سیستم نوری و تکرار پذیری بینظیر آن است. این ویژگیها سبب شده است تادستگاه نیازی به صفرشدن (Zeroing) با محلول شاهد نداشته باشد. در بسیاری از آزمایشها شاهد آب مقطر بعلاوه واکنشگرها بوده و مطابق روش تهیه نمونه آماده میشود. این بدان معناست که تعدادی از تستهای هر کیت بدون آنکه به آن خیلی توجه شود برای صفر کردن با شاهد مصرف میشود در نتیجه هزینه هر تست برای رقبای مرک در اصل میتواند تا دو برابر بیش از آن چیزی که بیان میشود باشد در حالیکه فتومترهای مرک هزینه این صفر کردن با شاهد را برای شما پس انداز میکند. و ممکن است بعد از مدتی از این پس انداز قیمت خرید دستگاه فتومتر برگردد.
۶-کالیبراسیون اسپکترو فتومتریکی از نیازمندیهای اساسی درانجام آنالیز با اسپکتروفتومتر کالیبره بودن دستگاه و تست کیتها میباشد و این کالیبراسیون باید بسهولت و حتی توسط خود کاربر انجام شود. راه حل برآورده کردن این نیازمندی از قبل در اسپکتروفتومتر فارو مرک آلمان در قالب سیستم AQA (Analytical Quality Assurance) دیده شده است. با استفاده از استانداردهای قابل ردیابی به یک استاندارد اولیه شما میتواند از وجود خطاء و منشاء آن در سیستم آنالیز مطلع شوید.
شرح آزمایش: ابتدا ۵cc اسید کلریدریک را داخل بوته حاوی خاکستر ریخته و آن با آژیتاتور هم میزنیم سپس بوته را روی بن ماری قرار داده تا اسید تبخیر شود مجددا ۲cc اسید کلریدریک به بوته اضافه کرده و ۵ دقیقه دیگر روی بن ماری قرار میدهیم سپس مواد داخل بوته را داخل یک بالن ۱۰۰cc صاف میکنیم و به حجم میرسانیم.
۲۰ml از نمونه خاکستر را دخل بالن ۵۰ریخته و ۲ml هیرو کسیل آمین به آن اضافه کرده و ۱۰دقیقه صبر میکنیم تا کاملا احیا شود. بعد از ۱۰ دقیقه ۱۰ml محلول تامپون و ۲ml محلول ارتوفنانترولین به آن اضافه میکنیم وبالن را به حجم میرسانیم و کوت اسپکتومتر را از محلول پر کرده و داخل دستگاه قرار میدهیم و طول موج دستگاه را روی ۵۱۰nm تنظیم میکنیم سپس میزان جذب نور را از دستگاه میخوانیم.

گزارش کار اندازه گيري دبي به كمك وسايل اندازه گيري - جمعه سیزدهم مرداد 1391
کلمه شیمی یعنی چی؟؟ - جمعه سیزدهم مرداد 1391
زندگینامه آلبرت انیشتین+ عکس رنگی! - جمعه سیزدهم مرداد 1391
معرفی سایتی در زمینه مواد شیمیایی - جمعه سیزدهم مرداد 1391
معرفی کامل رشته شیمی محض و کاربردی - جمعه سیزدهم مرداد 1391
دانلود کتاب تشریح مسائل مکانیک سیالات استریتر - پنجشنبه دوازدهم مرداد 1391
راهنمای حفظ کردن آسان جدول تناوبی - سه شنبه دهم مرداد 1391
دانلود و آموزش نرم افزار Chem 4D Demo - سه شنبه دهم مرداد 1391
سایت رشته صنایع شیمیایی...